研究実績・成果
研究実績・成果
研究成果の公表 生物学教室 日野 敏昭 准教授
卵子染色体の正常性維持におけるヒストン修飾の新たな役割を解明
~ヒストン修飾H3K4me3は卵染色体や紡錘体の安定性を制御する~
発表のポイント
- ヒストン修飾(※1)であるH3K4me3(※2)は主に転写活性化に関与する重要な制御機構として広く知られていますが、転写の起きていない卵子の染色体においてH3K4me3が多く存在しており、その機能は不明でした。
- 今回の研究により、マウス卵染色体上ではH3K4me3が皮質側に偏在する特殊な局在パターンを示し、卵染色体の正確な分配に関わる紡錘体(※3)の性質に影響を与え、受精後の正常発生にも必要であることを明らかにしました。
- 本研究により、遺伝子発現制御や胚発生において中心的役割を担うヒストン修飾の新たな機能を示しました。また、卵子における染色体異常は流産や遺伝子異常へとつながることが知られており、本研究で見つけたH3K4me3の機能との関わりの解明が今後期待されます。
研究の概要
卵子(卵母細胞)が受精後に正常発生するためには、染色体の正確な分配が必要不可欠であり、この機構の異常が不妊症や流産の原因の一つとなっています。成熟卵子(MII期卵)(※4)では、染色体が正しく機能するために多くのメカニズムが働いています。その一つに、染色体を構成するヒストンタンパク質の化学修飾があります。ヒストン修飾の内、H3K4me3は転写活性化に重要な役割を担うことが知られていますが、転写が行われていないMII期卵においても染色体上に多量に存在していることが知られていました。
本研究により、成熟卵染色体におけるH3K4me3は、遺伝子の転写制御とは異なる新たな役割として、染色体や紡錘体の安定性維持に必要であることを世界で初めて明らかにしました。
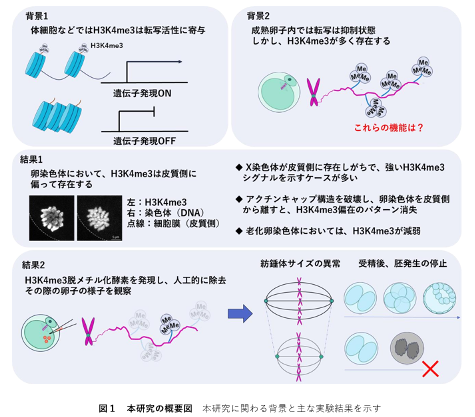
九州大学大学院農学研究院の宮本圭教授の研究グループ、近畿大学大学院生物理工学研究科の鷹巣篤志大学院生、山縣一夫教授、松本和也教授の研究グループ、旭川医科大学医学部の日野敏昭准教授、理化学研究所(理研)生命機能科学研究センターの北島智也チームリーダーの研究グループ、東京大学の大杉美穂教授、および理研バイオリソース研究センターの小倉淳郎室長の研究グループは、マウスの成熟卵染色体において細胞膜側(皮質側)にH3K4me3が蓄積していることを発見しました(図1)。さらにH3K4me3を卵子染色体から人工的に除去したところ、染色体を整列させる構造である紡錘体が不安定化し、受精後に正常な胚へと発生する能力が著しく低下することを明らかとしました。また、老化卵子においては、H3K4me3が異常に低下することも報告しております。
今回の発見は、広く研究されてきたH3K4me3の新たな機能を示す発見であるとともに、不妊治療や流産予防の分子標的として期待され、卵子の染色体分配異常の解明や治療への新たな道を拓くと考えられます。
本研究成果は米国科学誌「Journal of Biological Chemistry」に2025年5月29日(木)オンラインで先行公開されました。
研究の背景と経緯
卵子(卵母細胞)が受精後に正常発生するためには、染色体の正確な分配が必要不可欠です。特にMII 期卵は受精直前の段階であり、遺伝情報を次世代に正しく伝えるために、染色体を安定して正しく分配する仕組みが特に重要です。また、これら機能解明は、不妊症や流産を引き起こす原因究明にもつながります。
染色体の機能を制御する要素として、DNA に巻き付くタンパク質(ヒストン)の化学的な修飾(ヒストン修飾)が存在します。ヒストン修飾の一種である H3K4me3 は通常、遺伝子が活発に転写される際に現れますが、MII 期卵では遺伝子の転写が停止しているにもかかわらず、多量に存在することが知られており、H3K4me3 が MII 期卵で何らかの機能を有するかは、これまで不明でした。
研究の内容と成果
本研究チームは、マウスの MII 期卵を用いて、染色体の位置とヒストン修飾 H3K4me3 の分布を、免疫蛍光染色(※5)法、マルチカラーFISH(※6)法、染色体個別動態解析(※7)により詳細に解析しました。その結果、染色体の細胞膜側(皮質側)に H3K4me3 が顕著に蓄積していることを確認しました(図 1)。また、この偏在が X 染色体といった特定の染色体上に特異的に起こっていることも明らかにしました。
次に、卵染色体における H3K4me3 の機能的役割を検討するため、MII 期卵内で H3K4me3 を人為的に除去しました。具体的には、H3K4me3 特異的デメチラーゼ(※8)を卵母細胞内に人工的に発現させることにより、染色体上の H3K4me3 レベルを大幅に低下させました。その結果、染色体を整列・分配させるために重要な紡錘体構造が不安定化し、紡錘体が通常より短縮することを顕微鏡観察で確認しました。さらに、H3K4me3 が除去された卵母細胞を体外受精させると、正常な胚発生能力が低下し、特に受精後の 2 細胞期以降への進行が大幅に抑制されることを示しました。
また、卵母細胞内の染色体位置を決定するアクチンキャップ構造(※9)と H3K4me3 の分布の関連性を検討するため、アクチンキャップを薬剤により破壊したところ、染色体が細胞中央部に移動し、H3K4me3 の局在も変化しました。このことから、H3K4me3 がアクチンキャップ構造を介した皮質付近への染色体局在が H3K4me3 の特異的な偏在パターンに重要な役割を果たしていることが示唆されました。
さらに、高齢のマウス卵母細胞では H3K4me3 のレベルが低下することを発見し、これが加齢に伴う卵子品質低下の原因の一つとなっている可能性を指摘しました。
以上の結果から、卵子における H3K4me3 は、染色体と紡錘体の安定化に直接関与しており、正常な卵子の発生とその後の胚発生能力に極めて重要であることを証明しました。また、H3K4me3 が転写の活性化以外の役割を有することを示した報告でもあります。本研究でわかったことを図 1 にまとめております。
今後の展開
今回の研究により、従来は主に遺伝子のオン・オフを調節する働きが知られていたヒストン修飾が、転写が停止した卵子においても染色体の安定化という新たな機能を果たしていることがわかりました。今後は、卵子の染色体分配が乱れるメカニズムをさらに詳細に解明し、ヒストン修飾を標的とした新しい不妊治療法の開発や、加齢による卵子品質低下の予防につながる医療応用が期待されます。
用語解説
※1 ヒストン修飾
ヒストンとは細胞核内にあるDNAが巻き付いているタンパク質のことを指す。DNAをコンパクトにまとめると同時に、遺伝子の発現制御にも関与する。特に、ヒストンに化学的な修飾(メチル化、アセチル化など)が加えられる現象のことをヒストン修飾と呼ぶ。これにより、周囲のDNAの構造や遺伝子のオン・オフが調節される。
※2 H3K4me3(ヒストンH3のリジン4のトリメチル化)
ヒストンH3タンパク質の4番目のリジンに3つのメチル基が付加された修飾。一般的には活性型の遺伝子領域に存在し、転写活性と関連している。
※3 紡錘体
細胞分裂時に染色体を分配するために形成される繊維状構造。微小管から構成される。
※4 成熟卵子(MII期卵)
受精可能な卵子が出来上がるまでには、卵母細胞という卵子の元となる細胞が発育し、減数分裂を経てMII(metaphaseII)期まで成熟する必要がある。精子と受精して発生を開始できる状態で細胞周期を停止している卵子のことを特に、MII期卵とよぶ。
※5 免疫蛍光染色
特定のタンパク質を検出するために、蛍光で標識された抗体を用いて可視化する方法。顕微鏡で観察可能。
※6 マルチカラーFISH
特定の染色体を認識するプローブの組み合わせを用いて、染色体全体の数や構造を評価する手法。
※7 染色体個別動態解析
理研 北島智也チームディレクターの染色体分配研究チームによって開発された、個別の卵染色体をラベリングし、ライブセルイメージングで観察する方法。
Osamu Takenouchi, Yogo Sakakibara, Tomoya S. Kitajima, "Live chromosome identifying and tracking reveals size-based spatial pathway of meiotic errors in oocytes", Science,10.1126/science.adn5529
※8 デメチラーゼ(ヒストン脱メチル化酵素)
ヒストンからメチル基を取り除く酵素。ヒストン修飾の状態を変化させることで、遺伝子の発現やクロマチン構造に影響を与える。
※9 アクチンキャップ構造
卵母細胞の皮質側に形成されるアクチンフィラメントによるドーム状の構造。染色体や紡錘体を皮質側に安定的に配置させる働きを持つ。
論文情報
【掲載誌】
Journal of Biological Chemistry
【タイトル】
Characterization of H3K4me3 in mouse oocytes at the metaphase II stage
【著者名】
Atsushi Takasu, Toshiaki Hino, Osamu Takenouchi, Yasuki Miyagawa, Zhihua Liang, Shota Tanaka, Tomoya Mimura, Chisato Ida, Yuki Matsuo, Yuna Lee, Haruka Ikegami, Miho Ohsugi, Shogo Matoba, Atsuo Ogura, Kazuo Yamagata, Kazuya Matsumoto, Tomoya S Kitajima, Kei Miyamoto
【DOI】
10.1016/j.jbc.2025.110308
【研究に関するお問合せ】
旭川医科大学 生物学 准教授 日野 敏昭
TEL:0166-68-2730
