研究実績・成果
研究実績・成果
共同研究成果の公表 小児科学講座 東 寛 名誉教授
このたび、本学小児科学講座 東 寛 名誉教授が研究代表者として奈良県立医科大学等と共同研究した研究成果が米国血液学会誌Blood Advances(First Edition)に掲載されました。
人工赤血球製剤ヘモグロビンベシクルの臨床第一相試験を実施
輸血治療は現行の医療に不可欠であり、国民の医療と健康福祉に多大な貢献をしています。しかし、離島・僻地における医療、プレホスピタル、夜間救急、緊急手術、大規模災害の発生時など、危機的出血にある傷病者に対し輸血が出来ない(間に合わない)状況が今なお想定されます。本研究班では、そのような課題をもつ輸血治療を「補完」することのできる製剤として、長期間備蓄でき、血液型の不一致や感染の心配をすることなく、いつでも必要時に投与できる人工赤血球製剤(人工酸素運搬体)を開発し、動物投与試験によりその有効性と安全性を明らかにしてきました。
この度、人工赤血球ヘモグロビンベシクル のヒトへの初回投与である臨床第一相試験(Phase I)を国内で実施し、その試験成果が2022年8月8日に米国血液学会誌Blood Advances(First Edition)に掲載されました (*本掲載は10~11月頃の見込み)。
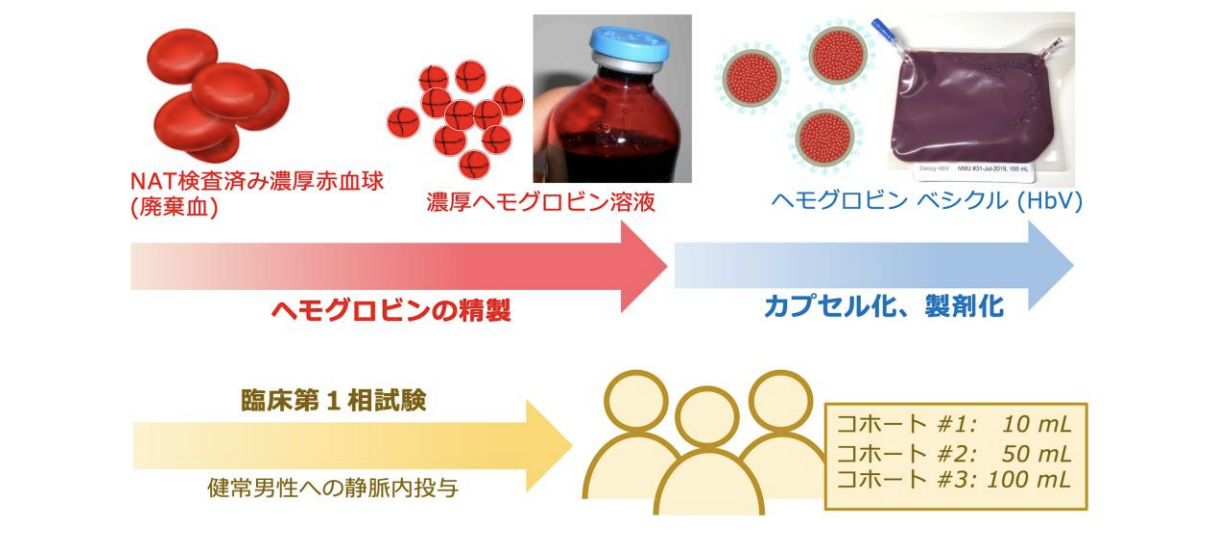
研究の詳細
背景
人工赤血球製剤(ヘモグロビン ベシクル)*1の有効性や安全性については、これまでに動物投与試験により詳細が明らかになっている。特に、大量出血に伴うショック状態に対する蘇生液として産科危機的出血、制御不能出血、術中出血に対する投与効果のほか、体外循環回路の充填液、摘出臓器の灌流保存液としての使用、虚血性組織やがん組織の酸素化、血管腫レーザー治療の標的としての利用など、実験的に様々な投与効果が確認され、その実用化が待たれている。
本製剤の原料となるヘモグロビンは、使われずに廃棄される献血血液から精製単離したものである。廃棄される血液の成分を有効利用し、すべての献血者の善意を無駄にしないことは、1980年代から続く本製剤の研究開発の契機である。また、現場医師からの本製剤に対する切実な思いが研究開発の推進力となっている。
しかし、大量投与を前提とした従来に無い範疇の製剤であり、血液製剤として開発のハードルが高いことに加え、海外諸国と比べて危機管理意識の低い日本においては市場性が明確ではないとの見方もあり、製薬企業との共同が困難な状況にあった。それでもなお研究目的が明瞭で、実用化後の医療全般への波及効果が期待されることから、アカデミア(大学・研究機関)が主体となって研究開発を継続してきた。2015年度からは日本医療研究開発機構(AMED)の支援を受け、輸血の代替物としての本製剤の安全性・有効性について先見的研究を継続するとともに、医薬品医療機器総合機構(PMDA)のRS薬事戦略面談を重ねて製造工程を確立し、GLP*2非臨床安全性試験を順次進めた。また、治験薬GMP製造*3と治験実施に備えてきた。
研究成果
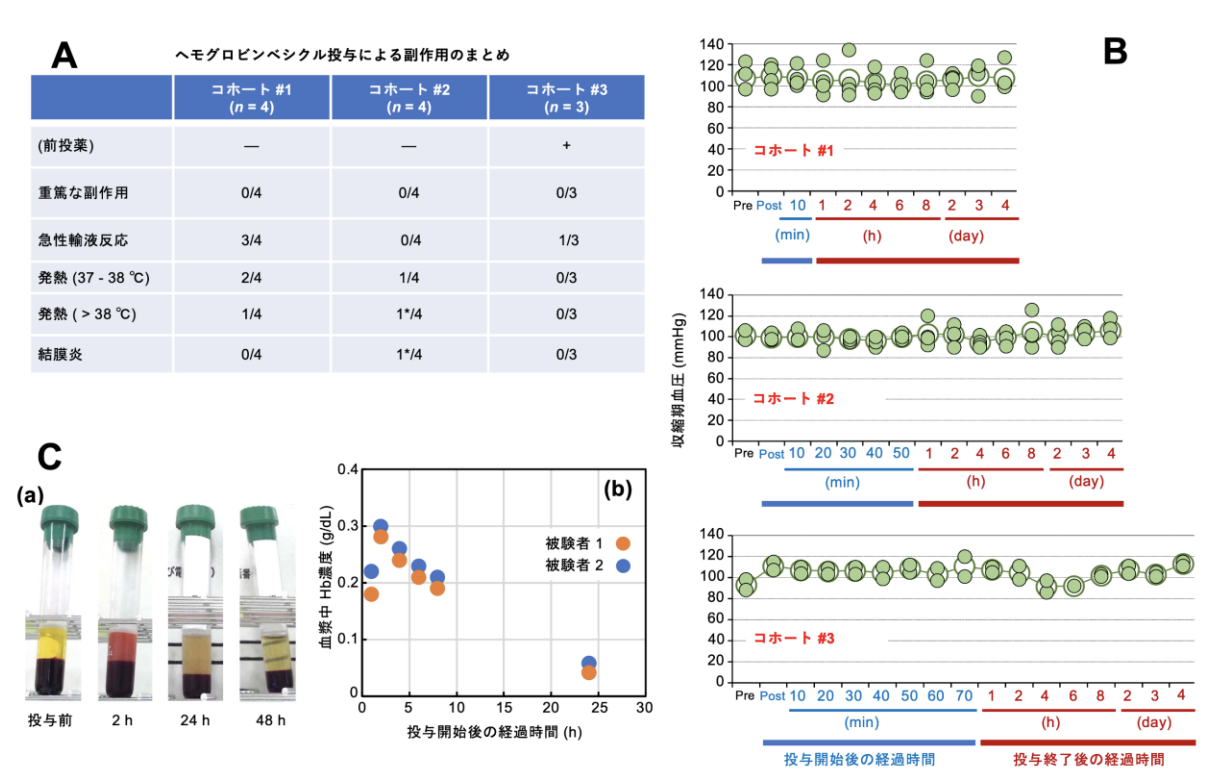
治験薬(NMU-HbV)*4の製造は、2020年より奈良県立医科大学附属病院移植細胞培養センターにて実施され、品質確認を経てPhase I 試験に供した。Phase I試験は、旭川医科大学 臨床研究支援センターおよび北海道大学病院 臨床研究開発センターを橋渡し支援拠点とし、両施設のARO*5機能を活用して実施された。Phase I試験計画についてPMDAのRS戦略相談での合意と、北海道大学治験審査委員会の承認を得て、2020年10月から北海道大学病院にて開始された。被験者は健康成人男性とした。NMU-HbV(Hb濃度10 g/dL)の投与量はコホート#1, #2, #3でそれぞれ10 mL (0.2mL/kg, 投与時間 30 min), 50 mL (1.0 mL/kg, 投与時間70min),100mL(2mL/kg, 投与時間90 min)、最大投与速度は、コホート#1では 1 mL/min、コホート#2, #3では2.5mL/minの静脈投与とした。安全性(有害事象の発生;投与後の自覚・他覚症状、血液生化学検査値の変動等)、血行動態、治験薬の薬物動態について評価した。コホート#3では、治験薬投与前に前投薬(dexamethasone, famotidine, acetaminophen)を行なった。結果として、全てのコホートについて重篤な有害事象を認めた例はなかった(図1)。急性輸液反応*6や発熱などが認められたが、自然軽快した。血液・生化学検査、バイタルサインの変動は関連する自他覚症状もなく、全て正常値に回復した。修飾ヘモグロビン溶液系の投与でみられる血圧上昇は、本製剤の投与では無く、血管収縮作用は軽微と考えられた。100 mLを投与したコホート#3において、2時間後の血漿中Hb濃度は0.28〜0.3 g/dLで、半減期は約8時間と推定された。半減期は投与量の増大に応じて延長することが知られており、輸血代替として十分に機能することが考えられた。これらの成果を踏まえて、2021年度からはAMED橋渡し研究プログラム(シーズB)として、投与量を増やして安全性をみるための臨床第二相試験(Phase II)の実施に向けた準備を進めている。
用語説明
*1 人工赤血球:ヘモグロビンベシクル(Hemoglobin Vesicles, HbV)ともいう。粒径約 250 nm のリポソーム粒子に高純度・高濃度ヒトヘモグロビン溶液を内包し、赤血球と同等の酸素運搬機能がある。ヘモグロビンの精製工程でウィルス不活化・除去工程を導入してあるので、感染の心配は無い。また、赤血球膜表面にある血液型抗原も排除しているので、人工赤血球に血液型は無い。脱酸素状態にすることにより室温で2年以上の保存が可能である。
*2 GLP:Good Laboratory Practice の略。非臨床試験の信頼性を高めるために決められた厚生労働省の省令のかたちで施行された実施基準。人を対象とした臨床試験の前段階として GLP に準拠した非臨床試験が必要とされている。
*3 GMP:Good Manufacturing Practice の略。医薬品の製造管理および品質管理に関する基準であり、治験薬製造において遵守すべき基準。
*4 NMU-HbV:治験薬名。Nara Medical University-Hemoglobin Vesicles の頭文字を取ったもの。
*5 ARO:Academic Research Organization の略。研究機関や医療機関等を有する大学等がその機能を活用して、医薬品開発等を含め、臨床研究・非臨床研究を支援する組織。
*6 急性輸液反応:薬剤投与中または投与開始後 24 時間以内に現れる過敏症などの症状の総称。発生機序は明確でないが、サイトカイン放出に伴い、一過性の炎症やアレルギー反応が引き起こされると推測されている。前投薬によって予防あるいは症状の軽減が可能である。
発表論文
雑誌名:Blood Advances (米国血液学会誌)
論文名:First-in-human phase 1 trial of hemoglobin vesicles as artificial red blood cells developed for use as a transfusion alternative (輸血代替として開発された人工赤血球ヘモグロビンベシクルのヒト初回投与 臨床第1相試験).
掲載日:First Edition (2022年8月8日)、本掲載(2022年10~11月頃の見込み)
DOI: 10.1182/bloodadvances.2022007977
著者と所属先
◎は研究代表者、○は治験責任医師、*は連絡先の著者・治験薬開発者
◎東 寛 (旭川医科大学 小児科学講座)
○天野 虎次 (北海道大学病院 臨床研究開発センター)
神山 直也 (旭川医科大学病院 臨床研究支援センター)
竹原 有史 (旭川医科大学病院 臨床研究支援センター)
神宮 真希 (北海道大学病院 臨床研究開発センター)
高木はるみ (北海道大学病院 臨床研究開発センター)
杉田 修 (北海道大学病院 臨床研究開発センター)
小林 直子 (奈良県立医科大学 医学部化学教室)
久禮 智子 (奈良県立医科大学 医学部化学教室)
清水 太郎 (徳島大学大学院医歯薬学研究部 薬物動態制御学分野)
石田 竜弘 (徳島大学大学院医歯薬学研究部 薬物動態制御学分野)
松本 雅則 (奈良県立医科大学付属病院 輸血部)
*酒井 宏水 (奈良県立医科大学 医学部化学教室)
研究費
日本医療研究開発機構(AMED)
- 臨床研究・治験推進研究事業(2015-2017) (代表:酒井 宏水)
- 革新的医療シーズ実用化研究事業(2018-2021) (代表:東 寛)
- 橋渡し研究プログラム シーズB(2021-2023) (代表:酒井 宏水)
