
卵黄嚢由来の貪食細胞であるミクログリアは, 脳組織の不要物および有害物質の貪食・除去や, 脳内における自然免疫をつかさどっており, いわば脳マクロファージとして機能している. 外胚葉由来のアストロサイトは, 神経細胞に栄養代謝物を供給したり, 終足で脳血管を被覆して内皮細胞と共にグリア血管複合体を形成し, 血液脳関門の機能を制御したりしている. 1980年代McGeerらは, アルツハイマー病, レビー小体病, 筋萎縮性側索硬化症など様々な神経変性疾患の病変部位に共通して, ミクログリア, およびアストロサイトが活性化していることを発見した. McGeerらはこの発見を基に, 活性化グリアが関連する慢性炎症性変化によって神経細胞死が惹起・増強されるとするNeuroinflammation仮説を提唱した. 近年のPET研究, または死後脳研究によって, ミクログリアとアストロサイトは神経変性疾患のみならず, 統合失調症, 大うつ病といった内因性精神疾患においても, 活性化していることが明らかになり, Neuroinflammationは幅広い精神・神経疾患に共通した病態因子として認知されるようになった.
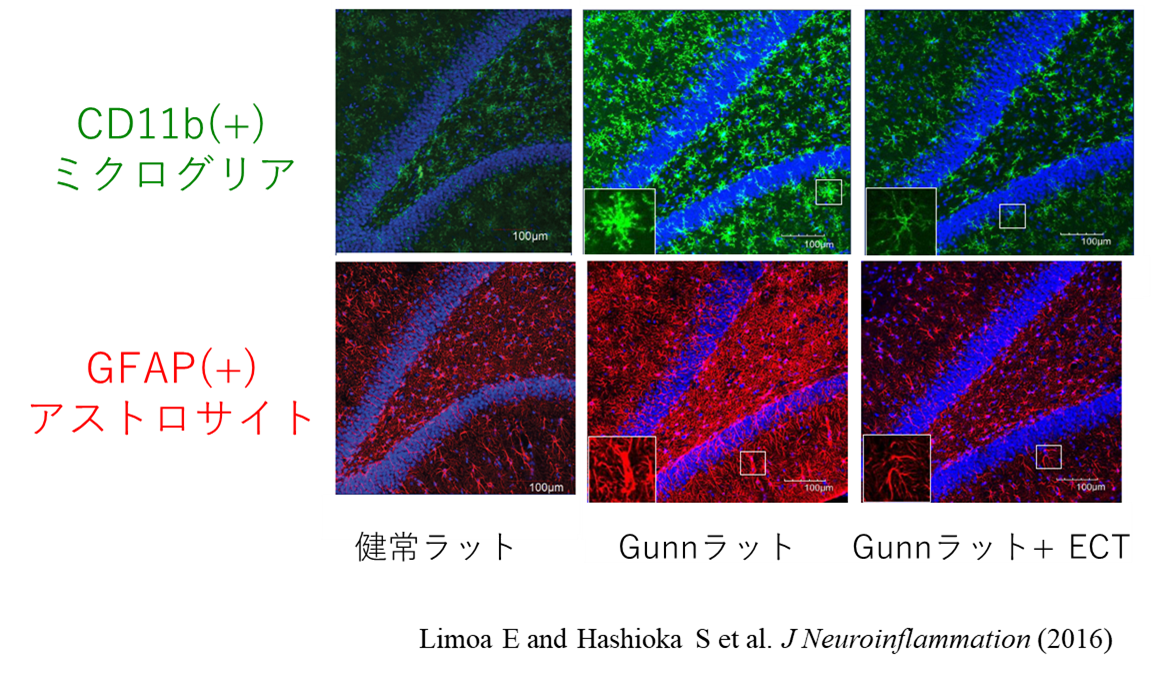
一方, 抗精神病薬, 抗うつ薬とも作用メカニズムとして従来, モノアミン仮説が主流であったが, 臨床効果との矛盾も散見されていた. そこで我々は, 新規治療標的としてグリアに着目し, これまで抗うつ薬, 抗精神病薬とも活性化ミクログリアを抑制することを明らかにしてきた[1-3]. また薬物抵抗性・難治性の内因性精神疾患に有効性を示す電気けいれん療法(ECT; electroconvulsive therapy)は, 実臨床における「最後の砦」, いわば現在の生物学的精神科治療の「ポジティブコントロール」的な治療法であるが, その効果発現メカニズムは未解明である. 先天的にミクログリア, アストロサイトとも活性化しており, 統合失調症様, 大うつ病様の異常行動を呈するGunnラット[4]にECTを施行し, ECTの効果発現メカニズムを検討した結果, ECTは異常行動の改善に伴い, 活性化ミクログリア, 活性化アストロサイトを共に抑制することが分かった[5]. また, 活性化アストロサイトはグリア血管複合体の形成異常を来すが, ECTは治療効果発現の際, グリア血管複合体の形成異常を是正し, アストロサイト終足による脳血管被覆率を増加させることを見出した[6]. 今後もグリアの観点から, より詳細なECT効果発現メカニズムを分子レベルで解明し, 内因性精神疾患の究極の治療標的分子の同定, さらには新規治療法・予防法の開発を目指す.
- Hashioka S, Klegeris A, Monji A, Kato T, Sawada M, McGeer PL, Kanba S. Antidepressants inhibit interferon-γ-induced microglial production of IL-6 and nitric oxide. Exp. Neurol. 2007. 206: 33-42. (CI=257)
- Kato T, Monji A, Hashioka S, Kanba S. Risperidone significantly inhibits interferon-γ-induced microglial activation in vitro. Schizophr. Res. 2007. 92: 108-115. (CI=230)
- Bian Q, Kato T, Monji A, Hashioka S, Mizoguchi Y, Horikawa H, Kanba S. The effect of atypical antipsychotics, perospirone, ziprasidone and quetiapine on microglial activation induced by interferon-γ. Prog. Neuropsychopharmacol. Biol. Psychiatry 2008. 32: 42-48. (CI=214)
- Arauchi R* and Hashioka S* et al. Gunn rats with glial activation in the hippocampus show prolonged immobility time in the forced swimming test and tail suspension test. Brain Behav. 2018. e01028. *equal contribution (CI=33)
- Limoa E and Hashioka S et al. Electroconvulsive shock attenuated microgliosis and astrogliosis in the hippocampus and ameliorated schizophrenia-like behavior of Gunn rat. J. Neuroinflammation 2016. 13: 230. (CI=42)
- Azis IA and Hashioka S et al. Electroconvulsive shock restores the decreased coverage of brain blood vessels by astrocytic endfeet and ameliorates depressive-like behavior. J. Affect. Dis. 2019. 257: 331-339. (CI=21)

アストロサイトは, グリア中では最も数が多く, 神経細胞と同じ外胚葉由来である. アストロサイトは血液脳関門の機能制御や神経伝達物質の調節といった, 脳の恒常性維持に必須な役割を担っている. 神経変性疾患の病変部位において, アストロサイトはミクログリア同様, 活性化していることが形態学的に明らかにされているが, 活性化アストロサイトの機能としては, 神経傷害的に働いているのか, 神経保護的に働いているのか, 各々を示唆する研究結果がこれまで報告されており, 未だ議論の決着がついていない.
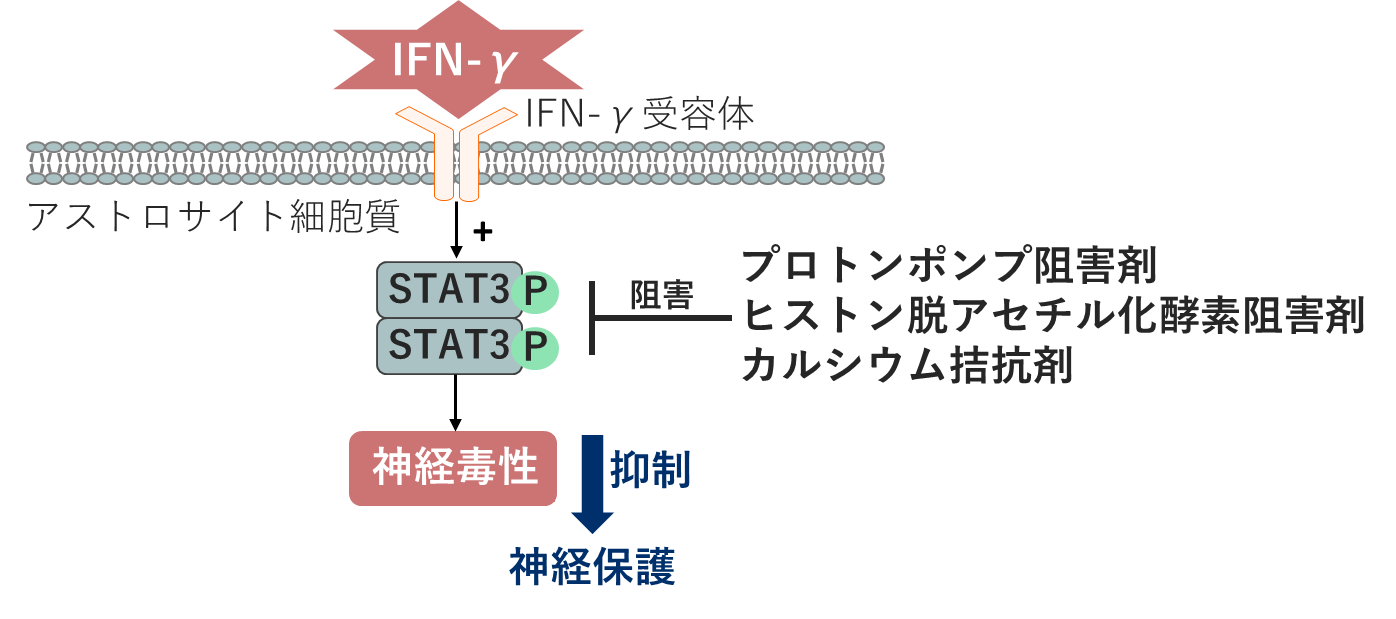
ヒトアストロサイトは, 内毒素リポポリサッカライドを含む様々な炎症惹起因子のうち, 主にT細胞が産生する炎症性サイトカインInterferon (IFN)-γによって活性化された場合のみ, 神経毒性を発揮することを我々は明らかにした[1]. 実際, ヒト脳においてIFN-γ受容体を発現しているのはアストロサイトのみで[1, 2], アルツハイマー病, レビー小体病, 多発性硬化症患者の死後脳では活性化アストロサイトによるIFN-γ受容体の発現が亢進していることを見出した[1]. 文献的に, これらの神経変性疾患患者の死後脳, あるいは脳脊髄液において, IFN-γそのものの発現が亢進していることがわかっている. また, IFN-γ活性化ヒトアストロサイトの神経毒性は, 炎症性転写因子であるSignal Transduction and Activator of Transcription (STAT)3の705チロシン残基のリン酸化を介して発現することを解明した[3]. さらに, その神経毒性を有意に抑制する薬剤をドラッグリポジショニングによって複数種同定した. 具体的には, プロトンポンプ阻害剤[4], L型カルシウム拮抗剤[5], ヒストン脱アセチル化酵素阻害剤[6]はいずれも活性化アストロサイト内におけるSTAT3の活性化を阻害することを明らかにした.
以上より, 活性化アストロサイトによる神経毒性は, 中核的病態機序とは言えないまでも, アルツハイマー病をはじめ, 認知症を引き起こすさまざまな神経変性疾患における共通したdriving forceとして関与している可能性がある. 今後, さらに詳細な活性化アストロサイトによる神経障害機序を解明し, その知見をもとに認知症の新規治療法開発を目指す.
- Hashioka S, Klegeris A, Schwab C, McGeer PL. Interferon-γ-dependent cytotoxic activation of human astrocytes and astrocytoma cells. Neurobiol. Aging 2009. 30: 1924-1935. (CI=111)
- Hashioka S, Klegeris A, Schwab C, Yu S, McGeer PL. Differential expression of interferon-γ receptor on human glial cells in vivo and in vitro. J. Neuroimmunol. 2010. 225: 91-99. (CI=57)
- Hashioka S, Klegeris A, Qing H, McGeer PL. STAT3 inhibitors attenuate interferon-γ-induced neurotoxicity and inflammatory molecule production by human astrocytes. Neurobiol. Dis. 2011. 41: 299-307. (CI=46)
- Hashioka S, Klegeris A, McGeer PL. Proton pump inhibitors reduce interferon-γ-induced neurotoxicity and STAT3 phosphorylation of human astrocytes. Glia 2011. 59: 833-840. (CI=40)
- Hashioka S, Klegeris A, McGeer PL. Inhibition of human astrocyte and microglia neurotoxicity by calcium channel blockers. Neuropharmacology 2012. 63: 685-691. (CI=68)
- Hashioka S, Klegeris A, McGeer PL. The histone deacetylase inhibitor suberoylanilide hydroxamic acid attenuates human astrocyte neurotoxicity induced by interferon-γ. J. Neuroinflammation 2012. 9: 113. (CI=25)
