| |
 |
|
|
 takai@asahikawa-med.ac.jp takai@asahikawa-med.ac.jp |
研究紹介 |
自律神経支配の効果器(平滑筋・心筋・分泌細胞など)の細胞膜受容体に接続する信号伝達系のうち、特に、イオンチャネルと蛋白質燐酸化のいずれか、または両方が関与する系に興味をもっています。 |
|
| プロフィール |
1954年、岐阜県郡上郡西川村(現・郡上市大和町)に生まれる。1973年、県立岐阜高校、1979年、名古屋大学医学部卒。同学部助手、講師、助教授を歴任。1986-1988年、Heidelberg大
第二生理学研究所留学。医博。2001年10月より現職。2007年4月より旭川医大情報基盤センター長を併任。2014年7月より、副学長(教育・研究・情報 担当)。
|
|
| 趣味: クラシック音楽、フルート [演奏1、演奏2、演奏3]。旭川医大室内合奏団、ブラスアンサンブルおよび写真部顧問 |
| 好きな食べ物:
何でも (特に、にぎり寿司、ビーフステーキ)。 |
| 苦手なもの: 蝶、蛾のたぐい(鱗翅類の昆虫)、鱗粉が気持ち悪い。 |
| 家族: 妻、2女、1男 |
| 血液型:
A 星座: 天秤 |
|
|
|
|
 |
|
 |
| |
 |
|
|
(citation index > 1500) |
| 2015/06/30 |
|
|
 |
|
 |
|
| |
|
| |
|
|
| |
I. 毛様体筋の電気生理学
視覚遠近調節でおなじみの毛様体筋の収縮調節メカニズムに関する研究を電気生理学と分子生物学の両面から進めています。
【なぜ毛様体筋?】 毛様体筋に興味をもったのは、遠近調節というわかりやすくて重要な機能に関与していることからだったのですが、研究を進めるうちに、ムスカリン受容体に接続する信号伝達系を研究するための恰好の実験モデル系であることに魅力を感じるようになりました。この平滑筋組織の収縮は、もっぱら副交感神経終末から遊離されるアセチルコリンにより調節され、ほかには直接的に関与する因子がほとんどなくてシンプルなので、実験的にとても都合がよいのです。
【研究の目標】 哺乳動物の眼球では、毛様体筋の収縮・弛緩により、水晶体(レンズ)の厚みを増減する(霊長類)か、前後に移動させる(他の大半の哺乳類)かにより、焦点合わせをしています。
この特殊に分化した平滑筋組織には、伝達物質(アセチルコリン)によるムスカリン受容体刺激に応じて迅速に張力を発生し(初期相)、そのレベルを一定に保持する(保持相)という特性があり、それが速やかで安定な焦点合わせを可能にしています(図1)。
従来の研究から、両相ともCa2+イオンを最終的な調節因子とすることは疑いないのですが、Ca2+動員経路には違いがあり、初期相では細胞内貯蔵部位からの迅速な遊離が、保持相では細胞外からの流入が重要と考えられています[1,2]。これらのうち、不明の点が多い保持相におけるCa2+流入経路の本体を突き止めるのが、私たちの当面の目標です(図1)。 |
| |
|
|
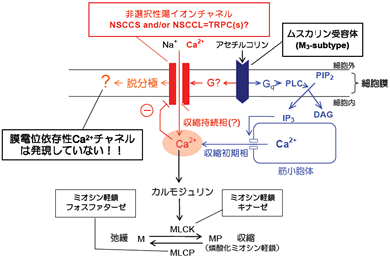 |
図1、毛様体筋の収縮調節機構(予想図)
毛様体筋収縮に必要なCa2+の動員経路としては、初期相では細胞内貯蔵部位からの遊離(青色)が、それにつぐ持続相では細胞外からの流入(赤色)が重要である。不明な点が多い赤色の経路の本体を明らかにすることが、われわれの目標である。 |
|
|
| |
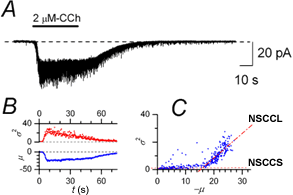
【二種類のイオンチャネル】 私たちは、ウシ毛様体単離平滑筋細胞において膜電位固定法により全細胞電流記録を行ってきました。そして、ムスカリン受容体刺激により発生する電流のノイズ成分を解析することにより、単一チャネルコンダクタンスが35
pSおよび100 fSと大きく異なる二種類の新規陽イオンチャネル(NSCCL および NSCCS)の開口を起す(図2)ことを明らかにしました[2]。また、それらを通る電流のノイズスペクトルを解析して、NSCCLとNSCCSが、いずれも3つ以上の開閉状態をとることを示唆するデータ(図3)を得ています[2]。
これら二つのチャネルのうち、特にNSCCSは、Ca2+をよく透過し、細胞あたりの数も多い[2]ので、多くの平滑筋組織に普通に見られる電位依存性Ca2+チャネルがほとんど発現していない毛様体筋において、主要なCa2+流入経路として働いている可能性が考えられます(図1)。 |
| |
|
|
|
 |
|
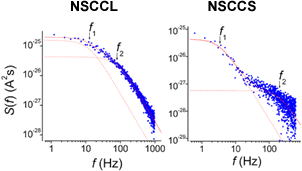 |
図2、ムスカリン受容体刺激により開口する二種類の非選択性陽イオンチャネル(NSCCLとNSCCS)
A, ウシ毛様体筋単離細胞における膜電位固定法(保持電位-50 mV)による全細胞電流記録。2 mM-carbachol (CCh)投与により著明なノイズを伴う内向き電流が観察された。B, 同じ記録を2 kHzでディジタル化し、500サンプルごとに平均(m )と分散(s2)とを計算した。C, m-s2プロット。勾配の大きく異なる二つの直線的成分は、単位コンダクタンスg が大きく異なる二種類の非選択性陽イオンチャネル(NSCCSとNSCCL)の開口に対応する。 この勾配から、NSCCSとNSCCLのg 値は、それぞれ、96 fSおよび35 pSと推定される。 (詳細[2]参照) |
|
|
図3、NSCCLとNSCCSのノイズスペクトル
図2Aと同様の実験において、2 mM-CChにより発生する内向き電流を記録。m-s2プロットで、NSCCL成分またはNSCCS成分のみを持つような比較的まれな細胞から得られた電流ノイズの周波数(f )成分をFFT法により計算した。NSCCSのノイズは、このチャネルを通りやすいBa2+を電荷担体として観察した。どちらのスペクトルにも少なくとも2つのLorentz成分(赤色の線)が認められる。これは、両チャネルが最低k=2+1=3つの異なる開閉状態をとることを示唆する。(詳細[2]参照) |
|
|
|
| |
【TRPとの関連】 TRP型陽イオンチャネルは、もともとショウジョウバエ複眼における光受容機構の研究の過程で発見されたものですが、近年その類似体が哺乳動物でも続々と発見されています。そして、それらのあるものが、上記のNSCCLやNSCCSの様な、いわゆる「受容体作動性」陽イオンチャネルとよく似た性質を示すという知見があいついで報告され、にわかに注目を集めるようになりました。
私たちは、ウシ、ブタ、モルモットなどの毛様体筋を含むいろいろな平滑筋組織でTRP(詳しくはそのTRPC亜型)のいくつかが発現していることをRT-PCRにより確認し(図4)、全cDNA配列を決定しました(GenBank ID: AB090949, AB090950 etc)[2]。さらに、それらの形質膜における発現を免疫蛍光染色による組織学的方法により確認しています[2a, 2b]。←
電気生理学的な方法で見つかったチャネルとこれらTRPC型チャネルとの関連性を示すデータも得られつつあります。近い将来、視覚遠近調節に関わる重要な経路の分子的本体を捉えることができるかもしれません。 |
| |
|
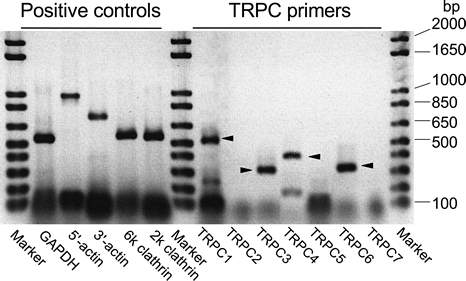 |
図4、ウシ毛様体筋における各種TRPC発現のRT-PCRによる検索
ウシ毛様体(全組織)について、ヒトやマウスなど哺乳動物TRPC1-7遺伝子の既知配列をもとに作成したいろいろなプライマペアを用いてRT-PCRを行った。その結果得られたPCR産物のアガロースゲル電気泳動像(SYBR-Gold蛍光染色、階調反転)を示す。この組織には、すくなくともmRNAレベルで、4種類(TRPC1,3,4および6)のTRPCが発現していることがわかった。(詳細[2, 2a, 2b]参照) ← |
|
|
| |
|
|
|
| |
|
|
| |
|
|
|
| |
II. プロテインフォスファターゼと阻害剤 
プロテインフォスファターゼとその特異的阻害剤の研究を内外の研究者と共同で行っています。
【きっかけ】 この種の酵素阻害剤の研究を始めたきっかけは、1986年暮、留学先のハイデルベルク大で海綿毒素の一種オカダ酸の平滑筋張力増強作用を調べていた時に、たまたま本物質が1型および2A型プロテインフォスファターゼ(PP1およびPP2A)[註]に対する特異的かつ高親和性の阻害剤であることを発見したことです[3,4,5]。
同類の阻害剤はそれ以前には記載がなく、最初に発表した論文[3]への反響も非常に大きかったことから、以後、オカダ酸を応用した平滑筋収縮[4]や各種イオンチャネル開閉[6,7]などにおけるPP1/PP2Aの調節的役割に関する研究を進めるかたわら、その後あいついで報告されたカリクリンA、ミクロシスチン、トートマイシンなど天然フォスファターゼ阻害毒素のPP1/PP2A結合メカニズム(図5)に関する研究にも手を染めることになりました。
[註]
真核生物細胞質の主要セリン/スレオニンプロテインフォスファターゼは4種類(PP1,
PP2A, PP2BおよびPP2C)に分類される。オカダ酸などの阻害剤はPP1とPP2Aを強く阻害する。PP2B(別名calcineurin)にはごく高濃度でのみ作用するが、PP2C
(Mg2+依存性酵素の一種)には全く無効である(次項表中A-Cの文献参照)。
|
| |
|
|
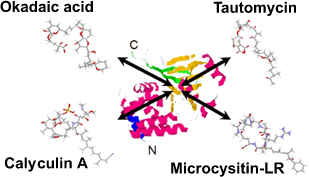 |
図5、PP1/PP2A阻害剤の酵素への結合
これまで知られているPP1/PP2A阻害剤は、binding
assay[10]の結果から、いずれも酵素の活性中心付近の同一部位に結合すると考えられている。このことは、酵素-阻害剤共結晶の三次元構造解析により、直接的に確かめられるようになった(図6参照)[13]。 |
| |
|
|
|
|
| |
| |
【これまでの成果】 オカダ酸をはじめとする天然毒素とPP1/PP2Aとの結合メカニズムに関するこれまでの研究の主要成果にはつぎのようなものがあります。
これらの阻害剤は、いずれもターゲット分子であるPP1やPP2Aに対しpM-nMオーダーの極低濃度で作用します。一般に、このような高親和性リガンドは、親和性がそれほど高くない古典的なリガンドには見られない、反応速度論的に一見非常に特異な性質を示す傾向があります(上表B,C,Dの文献参照)。
そのため、私たちの研究の過程でも、たとえば、濃度-抑制実験やbinding
assayの結果から解離定数を推定する場合など、「高親和性」ということに特別の注意を払ったいくつかの新しいデータ解析法の導入が必要になりました[8-12]。
私がこの方面の研究を行ってきた時期は、たまたまパソコンと解析ソフトが驚異的に発達普及する時期と重なっていましたので、かなり込み入った数値演算を必要とするそのような解析法をすぐに日常的に使用することができたのはとても幸運でした。
【現在の課題】 これまで知られている上記のような天然毒素は、確かにPP1とPP2Aの両方に阻害作用を示しますが、濃度−抑制関係を定量的に調べてみると、その大半がPP1によりもPP2Aにより高い親和性(解離定数の比にして10-10000倍)を示すことがわかっています[10]。
応用面でも重要なこのPP2AとPP1への親和性の違いが酵素の阻害剤結合部位のどのような構造的相違に基づくものであるかに、私たちは以前から興味を持ってきました。
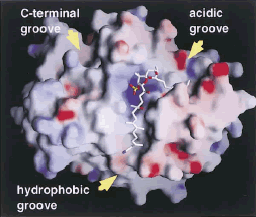
この点に関して、大腸菌で大量発現したPP1アイソザイム(a, b, g )と阻害剤の共結晶を作りX線解析により結合の様子を三次元的に見ようという試みが世界各地でなされています。私たちも最近、X線解析の専門家と協力して、PP1g -カリクリンA共結晶の三次元構造解析に成功しました(図6)[13]。また、有機合成化学の専門家との共同研究で、炭素骨格の特定部位を13Cで置換ラベルしたトートマイシンを用い、NMRにより水溶液中でのPP1g-トートマイシン結合の様子をを分子レベルで解析しようという試みにも挑戦しています[13a,13b,13c]。
もしPP2Aについても各阻害剤について同じことができれば私たちの宿年の課題が解けるはずです。しかし残念ながら、PP2Aという酵素は大腸菌で発現させようとすると不溶な封入体を形成してしまい、なかなかうまくいかないのです。これまでも、かなり多くの専門家が挑戦してきましたが、いまだに成功したという報告がありません。
私たちは、PP2Aと分子シャペロンとの共発現や、塩基配列の一部を改変したPP2A発現ベクトルを用いる方法などを検討してきており、最近、ようやく有望な結果が得られ始めています。 |
| |
|
|
 |
| |
|
| |
図6、PP1g -calyculin
A結合体の三次元構造
大腸菌大量発現で得たPP1g アイソザイムとcalyculin
Aとを共結晶化し、X線解析によりその三次元構造を決定した。オカダ酸やミクロシスチンと同様、calyculin
Aも酵素の活性中心付近に結合していることが確かめられた。(Kita
ら[13]より) |
|
| |
|
|
|
|
| |
| |
【PP2Aの意外な使い道】 近い将来、首尾良く大量のPP2Aが大腸菌発現でとれたとしますと、上記のような学問的興味の他にも、次のようなちょっと意外な使い道が考えられます。
私の現在すんでいる北海道はホタテなど食用貝類の養殖が盛んですが、季節によっては貝が毒化し、特にいわゆるキモの部分を食べるとひどい下痢性中毒を起すことは広く知られています。
実は、そのような下痢性貝中毒の最も重要な原因毒が他ならぬオカダ酸とその誘導体なのです。ある季節にキモ(専門的には「中腸腺」、哺乳動物の肝臓と膵臓を合わせたような臓器)が特に危ないとされるのは、その時期に毒素を産生するプランクトンが多く発生し、それらを捕食する貝のその部分に蓄積するからに他なりません。
これについて私たちは、PP2Aの酵素活性に対する抑制作用を指標とした貝からのオカダ酸類毒素の超微量検出法を早くから提唱してきました[14]。オカダ酸類はPP2Aの活性をpMオーダの低濃度で抑制するので、研究室レベルでは、この方法で
1 pg (1兆分の1グラム)以下の超微量毒素を容易に検出定量することが可能です。
この方法をもとに安価で簡便なキットが開発できれば、貝の毒化を鋭敏に検知して養殖業者の経済的被害を未然に防ぐのに役立つはずです。ただ、それを実現するためには、まず何よりも大量のPP2Aをあまり手間とお金をかけずに手に入れる方法を考えなくてはなりません。
しかし、ウサギ骨格筋などから液体クロマト精製で得られるPP2Aはせいぜい1
mg程度(ウサギ数羽あたり)で、キット化の目的には労力的にも経費的にも現実的でありません。また、すでに早くから大腸菌による大量発現が可能になっているPP1アイソザイムも使えなくはありませんが、PP1の毒素への親和性はPP2Aの5000分の1なので原理的にあまり高い感度を期待できません。
そこで、大腸菌によるPP2Aの大量発現への挑戦ということになるのです。この研究がうまくいって、地元にも貢献できるとよいと思っております。
【新規酵素を求めて】 オカダ酸などPP1/PP2Aの特異的阻害剤の登場により、従来これら二つの主要酵素の圧倒的に強い活性の陰に隠れて研究がしにくかった微量フォスファターゼの研究が容易になりました。そこで、最近、新規微量フォスファターゼ群の同定・クローニングと、それらのイオンチャネル開閉調節など生理機能における役割に関する研究にも力を入れています[15,16]。 |
| |
|
|
|
|
|
| |
|
|
| |
|
| |
III. その他の興味
上で御紹介したPP1/PP2A阻害作用をもつ天然化合物についての共同研究がきっかけで、フグ毒テトロドトキシン(TTX)のNa+チャネル結合における構造-活性相関の検討[17]などの仕事にも参加してきました。
私たちがPP1/PP2A阻害剤の研究中に考案した「高親和性リガンド」に関するいくつかの反応速度論的データ解析法(上記)は、テトロドトキシンのような全く別系統の高親和性毒素の研究にも有用であることが証明されています(図7)。
超高親和性生理活性物質についての濃度-抑制関係の解析やbinding assayの企画などありましたら、どうかぜひお声をかけて下さい。 |
| |
|
|
|
 |
|
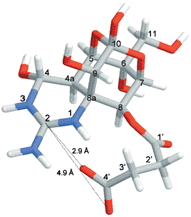
図7、TTX-8-O-hemisuccinate
TTXの化学的修飾により得られた誘導体のひとつ。理論的に最も安定な三次元構造を示す。水素を白、炭素を灰色、窒素を青、酸素を赤で表す。このような誘導体を用いた構造-活性相関の研究にも、われわれの「高親和性リガンド」の結合に関するデータ解析法が役立つ。(Yotsu-Yamashitaら[17]より) |
| |
|
|
|
|
|
|
|
| |
|
|
| |
|
関連論文
|
1. |
Takai
Y, Awaya S & Takai A (1997).
Activation of non-selective cation conductance by carbachol
in freshly isolated bovine ciliary muscle cells. Pflügers
Arch 433, 705-712. →PubMed |
|
|
2. |
Takai
Y, Sugawara R, Ohinata H & Takai
A (2004). Two types of non-selective cation
channel opened by muscarinic stimulation with carbachol
in bovine ciliary muscle cells. J Physiol 559, 899-922. →PubMed |
|
|
2a. |
Sugawara R, Takai Y, Miyazu M, Ohinata H, Yoshida A & Takai A (2006) Agonist and antagonist sensitivity of non-selective cation channel currents evoked by muscarinic receptor stimulation in bovine ciliary muscle cells. Auton Autacoid Pharmacol 26, 285-292. →PubMed |
|
|
2b. |
Yasui F, Miyazu M, Yoshida A, Naruse K & Takai A (2008). Examination of signalling pathways involved in muscarinc responses in bovine ciliary muscle using YM-254890, an inhibitor of the Gq/11 protein. Br J Pharmacol 154, 890-900. →PubMed |
|
|
3. |
Takai
A, Bialojan C, Troschka M & Rüegg JC (1987).
Smooth muscle myosin phosphatase inhibition and force
enhancement
by black sponge toxin. FEBS Lett 217,
81-84. →PubMed |
|
|
4. |
Bialojan
C, Rüegg JC & Takai A (1988). Effects of
okadaic acid on isometric tension and myosin phosphorylation
of chemically skinned guinea-pig taenia coli. J Physiol 398, 81-95. →PubMed |
|
|
5. |
Bialojan
C & Takai A (1988). Inhibitory
effect of a marine-sponge toxin, okadaic acid, on protein
phosphatases: specificity and kinetics. Biochem J 256,
283-290. →PubMed |
|
|
6. |
Hescheler
J, Mieskes G, Rüegg JC, Takai A & Trautwein
W (1988). Effects of a protein phosphatase inhibitor,
okadaic acid, on membrane currents of isolated guinea-pig
cardiac myocytes. Pflügers Arch 412, 248-252. →PubMed |
|
|
7. |
Kume
H, Takai A, Tokuno H & Tomita T (1989). Regulation
of Ca2+-dependent K+-channel activity in tracheal myocytes
by phosphorylation. Nature 341, 152-154. →PubMed |
|
|
8. |
Takai
A, Murata M, Torigoe K, Isobe M, Mieskes G & Yasumoto
T (1992). Inhibitory effect of okadaic acid derivatives
on protein phosphatases: a study on structure-affinity
relationship. Biochem J 284, 539-544. →PubMed |
|
|
9. |
Sasaki
K, Murata M, Yasumoto T, Mieskes G & Takai
A (1994). Affinity of okadaic acid to type-1 and type-2A
protein phosphatases is markedly reduced by oxidation
of its 27-hydroxyl group. Biochem J 298, 259-262. →PubMed |
|
|
10. |
Takai
A, Sasaki K, Nagai H, Mieskes G, Isobe M, Isono K & Yasumoto
T (1995). Inhibition of specific binding of okadaic
acid to protein phosphatase 2A by microcystin-LR,
calyculin-A and tautomycin: method of analysis of interactions
of tight-binding ligands with target protein. Biochem
J 306, 657-665. →PubMed |
|
|
11. |
Wakimoto
T, Matsunaga S, Takai A & Fusetani N (2002). Insight
into binding of calyculin A to protein phosphatase
1. Isolation of hemicalyculin A and chemical transformation
of calyculin A. Chem Biol 9, 309-319. →PubMed →Full Text (html) →Full Text (pdf) |
|
|
12. |
Takai
A, Ohno Y, Yasumoto T & Mieskes G (1992). Estimation
of the rate constants associated with the inhibitory
effect of okadaic acid on type 2A protein phosphatase
by time-course analysis. Biochem J 287, 101-106. →PubMed |
|
|
13. |
Kita
A, Matsunaga S, Takai A, Kataiwa H, Wakimoto T, Fusetani
N, Isobe M & Miki K (2002). Crystal structure
of the complex between calyculin A and the catalytic
subunit of protein phosphatase 1. Structure 10,
715-724. →PubMed →Full Text (html) →Full Text (pdf) |
|
|
13a. |
Isobe M, Kurono M, Tsuboi K & Takai A (2007). Synthesis of [18,19,21,22-13C4]-labeled tautomycin as an NMR probe of protein phosphatase inhibitor. Chem Asian J 2, 377-385. →PubMed |
|
|
13b. |
Sydnes MO, Kuse M, Kurono M, Shinomura A, Ohinata H, Takai A & Isobe M (2008). Protein phosphatase inhibitory activity of tautomycin photoaffinity probes evaluated at femto-molar level. Bioorg Med Chem 16, 1747-1755. →PubMed |
|
|
13c. |
Miyazaki A, Sydnes MO, Isobe M, Ohinata H, Miyazu M & Takai A (2009). Oxidatively induced Cu for Mn exchange in protein phosphatase 1g: a new method for active site analysis. Bioorg Med Chem 17, 7978-7986. →PubMed |
|
|
13d. |
Sydnes MO, Miyazaki A, Isobe M, Ohinata H, Miyazu M & Takai A (2010). Development of a new protein labeling starategy, oxidative labeling. part1: Preliminary evaluation and synthesis of tautomycin containing a metal coordinating unit. Tetrahedron 66, 1735-1741. →ScienceDirect  |
|
|
14. |
Takai
A & Mieskes G (1991). Inhibitory effect of
okadaic acid on the p-nitrophenyl phosphate phosphatase
activity of protein phosphatases [published erratum
appears in Biochem J 1992 Feb 1;281(Pt 3):879]. Biochem J 275,
233-239. →PubMed |
|
|
15. |
Zhou
SS, Takai A, Tominaga M & Okada Y (1997). Phosphatase-mediated
enhancement of cardiac cAMP-activated Cl- conductance
by a Cl- channel blocker, anthracene-9-carboxylate. Circ
Res 81, 219-228. →PubMed →Free Full Text (html) |
|
|
16. |
Zhou
SS, Takai A & Okada Y (2002). Regulation of
cardiac CFTR Cl- channel activity by a Mg2+-dependent
protein phosphatase. Pflügers Arch 444, 327-334. →PubMed →Full Text (html) →Full Text (pdf) |
|
|
17. |
Yotsu-Yamashita
M, Sugimoto A, Takai A & Yasumoto
T (1999). Effects of specific modifications of several
hydroxyls of tetrodotoxin on its affinity to rat brain
membrane. J Pharmacol Exp Ther 283,
1688-1696. →PubMed →Free Full Text (html) →Free Full Text (pdf) |
|
|
|
|
|
|
|
|
since

13
April 2004 |
|
|








