研究内容Project
主な研究テーマ
感染病態における細菌毒素の機能解析 Functional analysis of bacterial toxins in pathogenesis
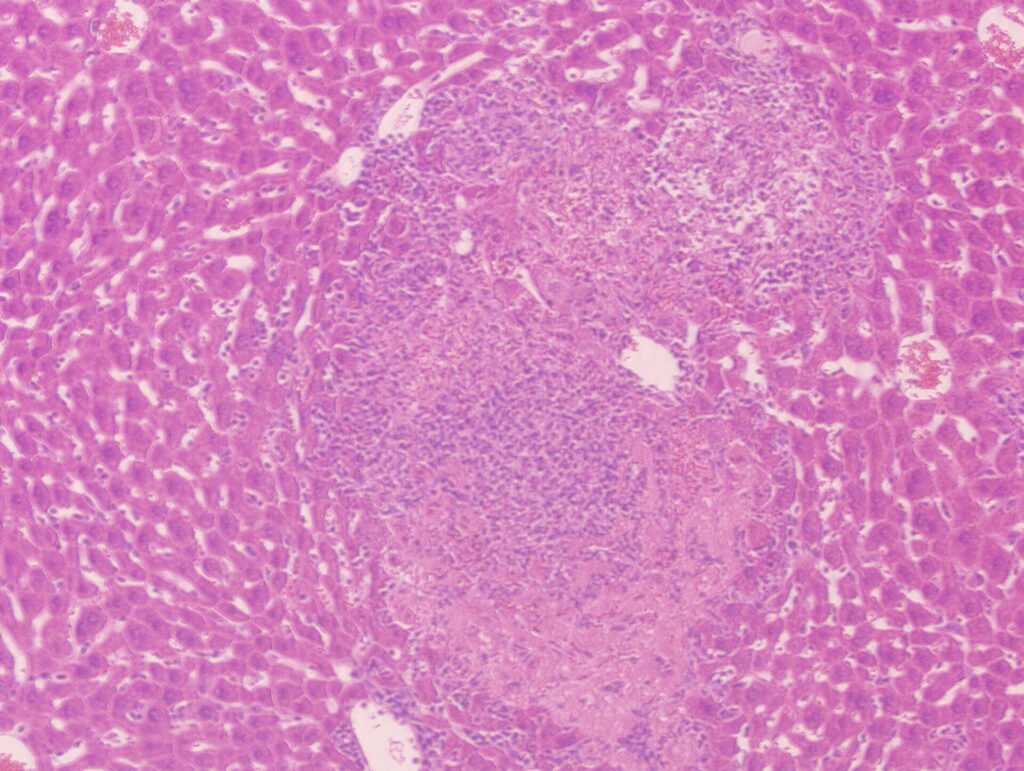
細菌はグラム陽性菌と陰性菌に大別されます。グラム陽性菌は多様な病原機構を有しており、様々な種類の毒素を産生することで病原性を発揮します。例えば、膜傷害毒素の主な機能は細胞膜に孔を形成することですが、それだけでなく様々な生物活性を有することが近年の研究から明らかになってきました。当研究グループでは、リステリアが産生する膜傷害毒素が感染宿主細胞のリン酸化酵素を活性化することで特異的な炎症応答を亢進し病原性に加担していることを報告しました(論文参照)。このように、病原毒素と宿主細胞との相互作用が感染病態に与える影響を分子レベルから解明することを目的として研究を進めています。
Bacteria are broadly classified into Gram-positive and Gram-negative groups. Gram-positive bacteria employ a wide range of virulence mechanisms and often cause disease by producing diverse toxins. For example, pore-forming toxins primarily create pores on host cell membranes, but recent studies have shown that they also have other biological activities. Our research group has reported that a pore-forming toxin produced by Listeria contributes to its pathogenesis by activating host kinases and thereby enhancing a specific inflammatory response (see our publication). We aim to elucidate how interactions between bacterial toxins and host cells shape infection outcomes at the molecular level.
代表的な論文:Tanishita Y, Sekiya H, Inohara N, Tsuchiya K, Mitsuyama M, Núñez G, ※Hara H. Listeria toxin promotes phosphorylation of the inflammasome adaptor ASC through Lyn and Syk to exacerbate pathogen expansion. Cell Reports 2022, 38, 110414. ※Corresponding author

感染症の重症化メカニズムの多角的解析 Multifaceted analysis of exacerbation mechanisms in infectious diseases
病原体が感染すると免疫細胞は異物として認識し炎症応答を誘発します。病原体を感知する受容体は細胞表面や細胞内に発現していますが、細胞内受容体を活性化するのは基本的に病原菌に限られます。当研究グループでは、リステリアや黄色ブドウ球菌などが細胞内受容体を介してインフラマソームとよばれる炎症応答を惹起し、感染病態を重症化させていることを報告しました(論文参照)。どのような微生物因子がこのインフラマソーム応答の活性化および制御に関わっているのか、また、どのような機構でインフラマソームを介した炎症応答が宿主を死に至らしめるのか解明することを目的として研究を行っています。
When a pathogen infects the host, immune cells recognize it as foreign and trigger inflammatory responses. Receptors that detect pathogens are expressed on the cell surface as well as inside cells, but intracellular receptors are generally activated during pathogen infection. Our research group has reported that pathogens such as Listeria monocytogenes and Staphylococcus aureus induce an inflammasome-mediated inflammatory responses via intracellular receptors, thereby exacerbating infection outcomes (see our publication). We are investigating which microbial factors are involved in activating and regulating inflammasome responses, and how inflammasome-driven inflammation exacerbates infection pathogenesis.
代表的な論文:※Hara H, Seregin SS, Yang D, Fukase K, Chamaillard M, Alnemri ES, Inohara N, Chen GY, Núñez G. The NLRP6 inflammasome recognizes lipoteichoic acid and regulates Gram-positive pathogen infection. Cell 2018, 175, 1651-1664. ※Corresponding author
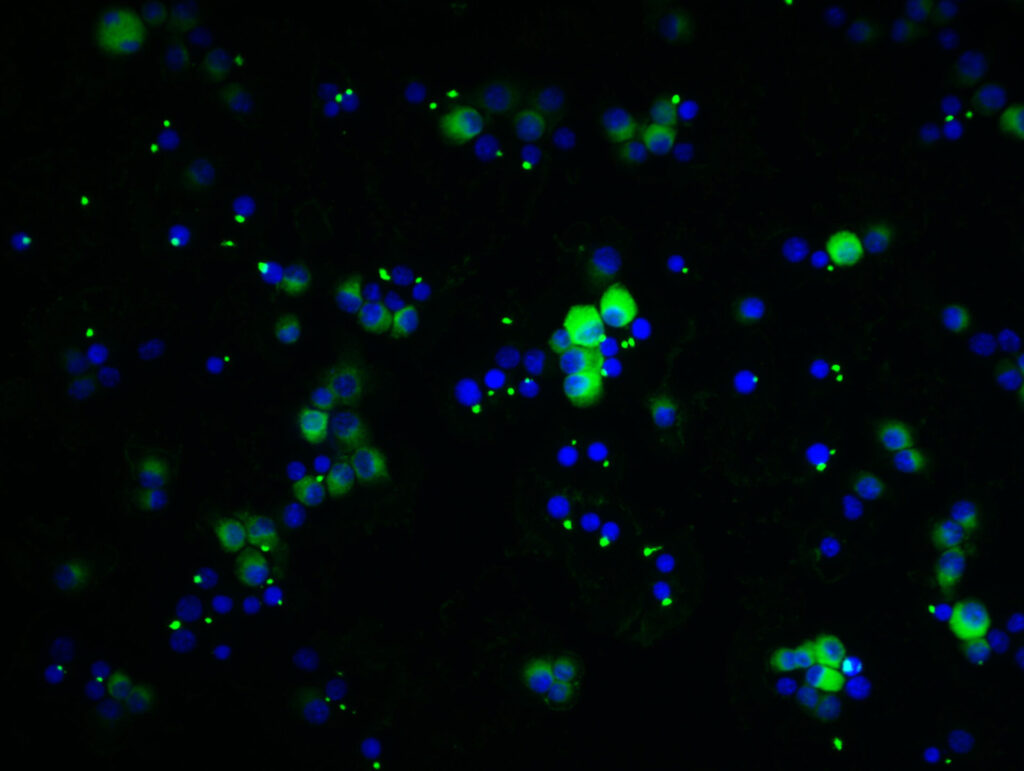
薬剤耐性菌問題に対する挑戦的研究 Innovative research against antimicrobial resistance
感染症における重要な医療問題の1つとして薬剤耐性菌の蔓延が挙げられます。国際的にも薬剤耐性菌のサイレント・パンデミックが問題視されていることから、抗生物質に代わる革新的な治療方針の転換が危急の課題となっています。新たな薬剤耐性を獲得させないことを念頭に、当研究グループでは菌体を標的としない治療法が考案できないか模索しています。その1つが感染症の悪化につながる炎症応答の抑制であり、いくつかの薬剤耐性菌に対して改善効果があることを最近明らかにしました(論文参照)。このような基礎研究で得られたエビデンスに基づき、前例のない治療標的の探索と新規モダリティの開発を目指しています。
Antimicrobial resistance is one of the most serious global issues in the world. As the “silent pandemic” of antimicrobial resistance has become a major international concern, there is an urgent need to shift toward innovative treatment strategies beyond conventional antibiotics. With the goal of avoiding the emergence of new resistance, our group is exploring therapeutic approaches that do not directly target the pathogen itself. One promising direction is to suppress inflammatory responses that drive disease worsening, and we have recently shown that this strategy can improve outcomes in several antimicrobial-resistant infections (see our publication). We aim to identify innovative therapeutic targets and develop new treatment modalities.
論文:投稿準備中